¿Qué es la energía?
La energía es algo que no podemos ver directamente, pero que está en todas partes y hace que las cosas funcionen. Es la capacidad que tiene algo para realizar un trabajo o producir un cambio. Por ejemplo, la energía hace que las luces se enciendan, que los autos se muevan y que los seres vivos, como nosotros, podamos crecer y movernos. Como la energía no tiene masa ni volumen solo podemos ver los efectos que causa sobre los cuerpos, de esa manera podemos distinguir diferentes tipos de energía según estos efectos.
Tipos de energía
Existen diferentes tipos de energía. Algunos de los más comunes son:
Energía mecánica La energía mecánica es la que está relacionada con el movimiento y la posición de los objetos. Es la energía que tienen las cosas cuando se mueven o cuando pueden moverse. Ejemplo: Una bicicleta al rodar o una pelota al ser lanzada.
- Energía química La energía química es la que está almacenada en las sustancias químicas, como los alimentos, las baterías o la gasolina. Esta energía se libera cuando ocurre una reacción química. Ejemplo: Cuando comemos, nuestro cuerpo transforma la energía química de los alimentos en energía para movernos y pensar. También, cuando quemamos madera, liberamos su energía química en forma de calor y luz.
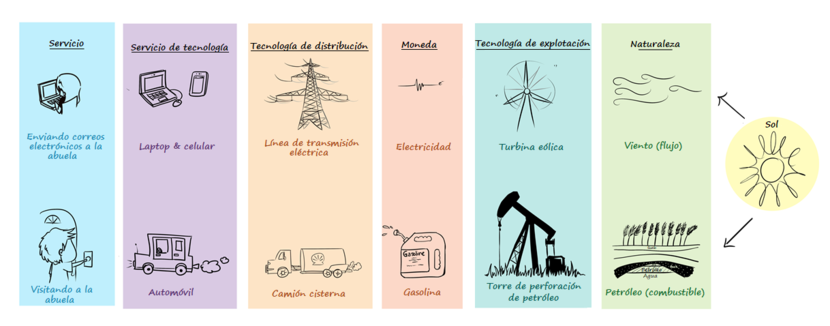
- Energía eléctrica La energía eléctrica es la que mueve las cargas eléctricas, como los electrones, a través de un conductor (como un cable). Es la forma de energía que usamos para hacer funcionar los aparatos eléctricos. Ejemplo: Al conectar una lámpara, la energía eléctrica viaja por los cables y hace que la bombilla se encienda.
- Energía luminosa La energía luminosa es la que emiten las fuentes de luz, como el sol, una bombilla o una vela. Nos permite ver todo lo que nos rodea. Ejemplo: La luz del sol es una forma de energía luminosa que permite que las plantas realicen la fotosíntesis y nos ilumina durante el día.
- Energía acústica La energía acústica es la que se produce a partir de las vibraciones que se propagan en el aire o en otros medios como el agua o los sólidos. Es lo que conocemos como sonido. Ejemplo: Cuando tocamos una guitarra, las cuerdas vibran y crean ondas sonoras que escuchamos como música.
- Energía calorífica (o térmica) La energía calorífica, también llamada energía térmica, es la que se relaciona con la temperatura de un objeto. Cuanto más caliente esté algo, más energía térmica tiene. Esta energía se transfiere de un objeto caliente a otro más frío. Ejemplo: Al calentar agua en una estufa, la energía térmica del fuego pasa al agua, aumentando su temperatura.
Características de la energía
- Transformación de la energía
La energía no se queda siempre igual, puede cambiar de una forma a otra. Esto se llama transformación de energía. Por ejemplo, cuando encendemos una bombilla, la energía eléctrica se convierte en luz y calor. Otro ejemplo es cuando comemos: la energía química de los alimentos se transforma en energía para movernos o pensar.
- Transferencia de energía
La transferencia de energía ocurre cuando la energía pasa de un objeto a otro. Por ejemplo, si juegas a patear una pelota, la energía de tus músculos se transfiere a la pelota, que se mueve al recibir esa energía. Otro ejemplo es el calor del sol, que se transfiere a la Tierra calentándola.
- Almacenamiento de energía
La energía también se puede almacenar para usarla más tarde. Un buen ejemplo es una batería. Cuando una batería está cargada, guarda energía química que puede usarse después para encender una linterna o un celular. Las plantas también almacenan energía en sus hojas y frutas gracias al sol, y esa energía se queda en los alimentos hasta que los comemos.
- Transportabilidad de la energía
La transportabilidad de la energía significa que la energía puede ser movida de un lugar a otro. La electricidad, por ejemplo, se transporta por cables desde las plantas de energía hasta nuestras casas para que podamos usarla. También podemos transportar energía química: cuando llevas una barra de chocolate en tu mochila, estás transportando energía que tu cuerpo usará cuando la comas.
A manera de resumen:
- La energía se transforma, como cuando la electricidad se convierte en luz en una bombilla.
- La energía se transfiere, como cuando pateas una pelota y esta se mueve.
- La energía se almacena, como la energía química en las baterías o los alimentos.
- La energía se transporta, como cuando la electricidad viaja por los cables a nuestras casas.
¿Por qué es importante la energía?
La energía es esencial para la vida. Sin ella, no podríamos encender luces, calentar la comida, usar aparatos electrónicos, ni movernos. Además, es importante cuidar la forma en que usamos la energía para no desperdiciarla y ayudar a cuidar el planeta.
Actividad de aprendizaje:
Consulta y escribe la definición de los siguientes términos relacionados: movimiento, fuerza, aceleración, trabajo, energía.
Consulta diferentes clases de energía.
Completa el cuadro sobre 5 actividades diarias y fuentes de energía para esas actividades.
Escribe 3 ejemplos sobre cada una de las propiedades de la energía: TRANSFORMACIÓN, TRANSFERENCIA, ALMACENAMIENTO Y TRANSPORTABILIDAD.
Escribe 3 ejemplos de energía MECÁNICA, QUÍMICA, ELÉCTRICA, LUMINOSA, ACÚSTICA Y CALORÍFICA.